di Edmondo Jonghi Lavarini
In un mondo dove l’acqua pura gela serenamente a 0 gradi Celsius, vi siete mai chiesti cosa accada quando questo liquido vitale non è così puro? Vi invitiamo a immergervi in un viaggio affascinante attraverso la chimica dell’acqua, dove il sale diventa il protagonista di una storia di trasformazione e mistero. Scoprite come un semplice pizzico di sale possa abbassare il punto di congelamento dell’acqua e quali meraviglie naturali e tecnologiche si nascondono dietro questo fenomeno. Dall’acqua dolce dei fiumi all’acqua salata degli oceani, fino alle incredibili acque del Mar Morto, preparatevi a esplorare come la salinità plasmi gli ecosistemi e influenzi la nostra vita quotidiana. Pronti a sfidare le vostre conoscenze e a scoprire i segreti gelidi dell’acqua salata? Questo articolo non solo stimolerà la vostra curiosità ma vi fornirà anche spunti di riflessione sulla straordinaria capacità dell’acqua di sorprendere e affascinare. Con una chiusura che vi lascerà con il sorriso, vi garantiamo un’esperienza di lettura che non potrete facilmente dimenticare. Imbarcatevi in questa avventura crioscopica e lasciatevi incantare dalla magia del congelamento dell’acqua salata.
Cos’è l’acqua?
L’acqua è una sostanza affascinante che nasconde molte peculiarità al di là della semplice formula H2O. Una delle sue caratteristiche più note è la capacità di passare da liquido a solido a 0 gradi Celsius, ma questo avviene solo se l’acqua è pura. La presenza di impurità, come il sale, altera il punto di congelamento dell’acqua, un fenomeno che gioca un ruolo cruciale in natura e nelle applicazioni umane.
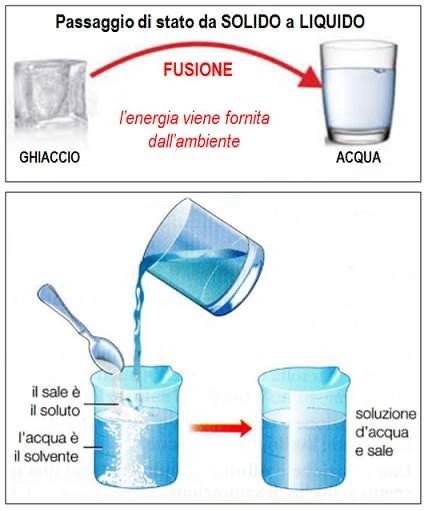
La chimica
Quando il sale (cloruro di sodio) viene sciolto in acqua, ione sodio e ione cloruro si disperdono nel liquido, interferendo con la formazione dei cristalli di ghiaccio. Questo processo, conosciuto come abbassamento crioscopico, è il motivo per cui il sale viene spesso spargito sulle strade in inverno per prevenire la formazione di ghiaccio.

Esempi pratici
Per esemplificare, immaginiamo di aggiungere sale all’acqua con una concentrazione crescente e osservare come varia il punto di congelamento:
- Acqua dolce: A 0 gradi Celsius, l’acqua pura congela. Questo è il punto di partenza, senza sale.
- Acqua leggermente salata: Con una bassa concentrazione di sale, simile a quella di alcuni fiumi che si mescolano con il mare, il punto di congelamento dell’acqua si abbassa di poco. Questa leggera differenza non è sufficiente per grandi effetti, ma inizia a mostrare come il sale influisce sull’acqua.
- Acqua di mare: La salinità media dell’oceano è di circa 35 grammi di sale per litro di acqua. Questa concentrazione di sale abbassa il punto di congelamento dell’acqua a circa -2 gradi Celsius. Questo fenomeno è vitale per la vita marina, permettendo agli oceani di rimanere liquidi anche in condizioni di freddo estremo.
- Mar Morto: Famoso per la sua elevatissima salinità, che può raggiungere fino a 300 grammi per litro, il Mar Morto ha un punto di congelamento ancora più basso. Sebbene non si congeli a causa del suo clima caldo, la sua straordinaria salinità dimostra come l’aggiunta di sale all’acqua possa drasticamente cambiarne le proprietà.
Scientificamente parlando
Per determinare il punto di congelamento dell’acqua con una concentrazione di sale di 300 grammi per litro, possiamo utilizzare la relazione empirica che lega l’abbassamento crioscopico alla concentrazione di soluto. La formula di base per l’abbassamento del punto di congelamento è:
[ \Delta T = i \cdot K_f \cdot m ]
dove:
- ( \Delta T ) è l’abbassamento del punto di congelamento,
- ( i ) è il fattore di van’t Hoff, che per il cloruro di sodio (NaCl) è 2 (poiché si dissocia in due ioni: Na+ e Cl-),
- ( K_f ) è la costante crioscopica dell’acqua, pari a 1.86 °C·kg/mol,
- ( m ) è la molalità del soluto, ovvero il numero di moli di soluto per kg di solvente.
Per calcolare ( m ), possiamo usare la concentrazione di sale di 300 g/L. Prima, convertiamo i grammi di sale in moli (sapendo che la massa molare del NaCl è circa 58.44 g/mol), e poi calcoliamo la molalità assumendo che la densità dell’acqua sia approssimativamente 1 kg/L, il che ci permette di considerare 1 L di soluzione come avente approssimativamente 1 kg di acqua.

In calcoli
Con una salinità di 300 grammi per litro, l’abbassamento del punto di congelamento dell’acqua sarebbe di circa 19.1 gradi Celsius. Ciò significa che, in teoria, l’acqua con questa concentrazione di sale inizierebbe a congelare a circa -19.1 gradi Celsius, molto al di sotto dello 0 gradi Celsius dell’acqua pura. Tuttavia, è importante ricordare che questa stima è basata su un’approssimazione che potrebbe non essere completamente accurata a concentrazioni così elevate di sale.
Concludendo
Se pensate che aggiungere un po’ di sale all’acqua del vostro bagno vi permetterà di fluttuare come nel Mar Morto, ricordatevi di non esagerare. Non vorrete trasformare la vasca da bagno in una pista di pattinaggio!


